【CMDE】鎳鈦合金紫杉醇洗脫血管支架審評報告公開
醫(yī)療器械產(chǎn)品注冊技術(shù)審評報告
產(chǎn)品中文名稱 :鎳鈦合金紫杉醇洗脫血管支架
產(chǎn)品英文(原文)名稱:ELUVIATM OVER-THE-WIRE Drug-Eluting Vascular Stent System
申請人名稱 :Boston Scientific Corporation 波士頓科學公司
國家藥品監(jiān)督管理局
醫(yī)療器械技術(shù)審評中心
基本信息
Boston Scientific Corporation (波士頓科學公司)
300 Boston Scientific Way, Marlborough, MA 01752, USA
Ballybrit Business Park, Galway, Ireland
波科國際醫(yī)療貿(mào)易(上海)有限公司
中國(上海)自由貿(mào)易試驗區(qū)日京路68號生產(chǎn)樓第二層A部位
產(chǎn)品審評摘要
(一)產(chǎn)品結(jié)構(gòu)及組成
該產(chǎn)品由藥物洗脫支架和輸送系統(tǒng)組成。支架是由鎳鈦 諾合金經(jīng)激光切割而成�����,支架近端和遠端帶有不透射線鉭標 記����;支架上涂層分為兩層,底漆和藥物基質(zhì)層���。底漆由聚(甲 基丙烯酸正丁酯)(PBMA)組成�����,藥物基質(zhì)層中藥物為紫杉 醇��,劑量密度 0.167 mg/mm2�,聚合物為偏二氟乙烯和六氟丙 烯(PVDF-HFP)共聚物�����。產(chǎn)品環(huán)氧乙烷滅菌,一次性使用��。
該產(chǎn)品用于治療原發(fā)股淺動脈(SFA)和/或腘動脈近端 有癥狀的原位或再狹窄病變��,以擴張血管直徑�����,參考血管直 徑(RVD)范圍為4.0-6.0 mm����。
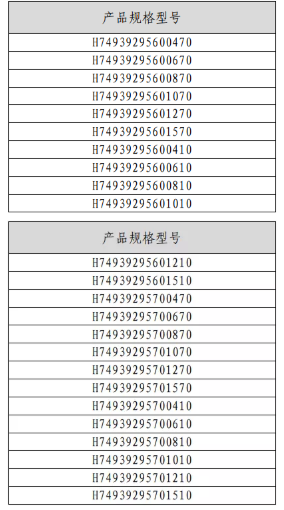
表1鎳鈦合金紫杉醇洗脫血管支架型號規(guī)格
鎳鈦合金紫杉醇洗脫血管支架是由支架系統(tǒng)和藥物涂 層(包含于聚合物基質(zhì)中的紫杉醇配方)組成。支架是由鎳 鈦合金(鎳鈦諾)組成的激光切割自擴張支架�,支架近端和 遠端上的不透射線鉭標記可提高支架的可視性,從而有助于 支架準確放置���。輸送系統(tǒng)為三軸設(shè)計:外軸固定支架輸送系 統(tǒng)��,中軸保護并約束支架�����,內(nèi)軸提供導絲內(nèi)腔���。支架含有藥 物/聚合物涂層,內(nèi)層為可提高外層粘附性的聚合物(PBMA)���;外層為由紫杉醇和PVDF-HFP聚合物載體組成���。當支架在血管 內(nèi)展開后,對血管內(nèi)腔產(chǎn)生的徑向力使支架植入?yún)^(qū)域內(nèi)保持 血管通暢�;紫杉醇藥物抑制內(nèi)膜增生并預(yù)期降低支架內(nèi)再狹 窄的發(fā)生率。
1.產(chǎn)品技術(shù)要求研究 技術(shù)要求研究項目如表 2 所示。
表 2 技術(shù)要求研究摘要
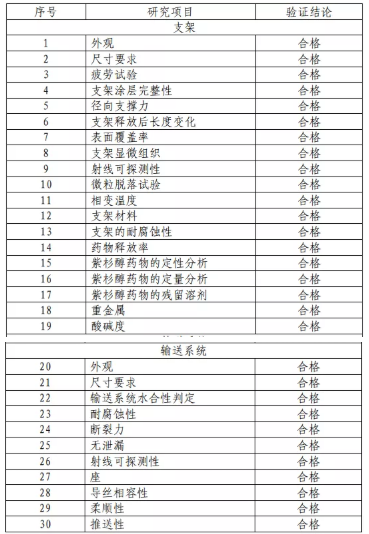
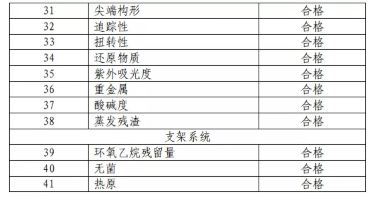
產(chǎn)品性能評價包括支架彎曲����,軸向、軸向和扭曲����、脈動 等疲勞性能,涂層完整性�,MRI 兼容性,支架展開精確度��, 輸送系統(tǒng)抗拉強度�,藥物含量���,藥物含量均勻度,藥物鑒別��, 藥物釋放�����,藥物體內(nèi)外釋放相關(guān)性等���。結(jié)果表明產(chǎn)品符合設(shè) 計輸入的要求���。
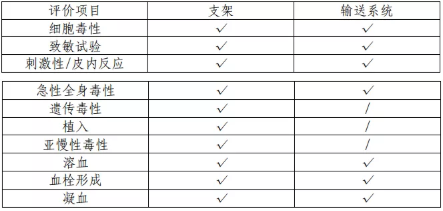
該產(chǎn)品由支架和輸送系統(tǒng)組成,其中支架為植入器械���, 與循環(huán)血液長期接觸�;輸送系統(tǒng)為外部接入器械�,與循環(huán)血 液短期接觸。申請人依據(jù) GB/T16886 系列標準對支架和輸送 系統(tǒng)進行生物相容性評價��。結(jié)果表明產(chǎn)品的生物相容性風險 可接受�。具體評價項目詳見表 3。
表 3 生物相容性評價項目表
該產(chǎn)品采用環(huán)氧乙烷滅菌�����,無菌狀態(tài)提供�。申請人提供 了滅菌確認報告,證明無菌保證水平為 10-6���。
該產(chǎn)品貨架有效期為兩年��。申請人提供了貨架有效期驗 證報告���,器械驗證實驗為以 25℃為基準的加速老化研究,藥 物相關(guān)驗證為 25℃±2℃/60%RH±5%RH 和 40℃±2℃/75%RH ±5%RH 長期穩(wěn)定性研究���,支持貨架有效期 2 年�。
申請人開展了豬模型的動物實驗以驗證藥物釋放��,產(chǎn)品 安全性和使用性能的研究�,這些試驗包括兩項評估藥代動力 學的研究,在動物體內(nèi)評估單個支架��,重疊支架對血管的反 應(yīng)�,及藥物劑量選擇三項研究;一項以驗證支架及輸送系統(tǒng) 達到產(chǎn)品所有性能和使用需求的研究���。動物實驗結(jié)果表明��, 產(chǎn)品達到預(yù)期設(shè)計要求����。
申請人按照《接受醫(yī)療器械境外臨床試驗數(shù)據(jù)技術(shù)指導 原則》(2018 年第 13 號)提交了如下主要的境外臨床試驗數(shù) 據(jù):
1.研究設(shè)計 IMPERIAL 臨床試驗是一項前瞻性��、全球多中心�����、單盲�、 2:1 (ELUVIA vs Zilver PTX)、非劣效性隨機對照臨床試驗 (RCT)��,以評價 ELUVIA 支架在治療患有股腘動脈病變患者 中的有效性和安全性��。在包括北美���、歐洲�、日本及新西蘭在 內(nèi)的 65 家研究中心共入組了 465 例病人(研究器械 ELUVIA 支架組 309 人�����,對照器械 Zilver PTX 組 156 人)。隨訪節(jié)點 分別為術(shù)后 1���、6���、12����、24、36�����、48 和 60 個月�。該項臨床試 驗的主要安全性終點為評價包括術(shù)后 1 個月內(nèi)的全因死亡、 12 個月內(nèi)靶肢體重癥截肢和靶病變血運重建(TLR)的主要 不良事件(MAE)����,旨在顯示 ELUVIA 組無 MAE 的患者比率非 劣于 Zilver PTX 組;主要有效性終點則為由血管多普勒超 聲(DUS)中心實驗室判定的術(shù)后 12 個月時的初始血管通暢 率����,旨在顯示 ELUVIA 組術(shù)后 12 個月時的初始血管通暢率非 劣于對照組。次要終點包括技術(shù)成功率�、手術(shù)成功率�、以及 6����、12、24 及 60 個月時由 DUS 判定的初始血管通暢率等���。
術(shù)后 12 個月時����,ELUVIA 組的初始血管通暢率為 86.8%��, 非劣效于 Zilver PTX 組的 81.5%�,達到該臨床試驗的主要有 效性終點;12 個月內(nèi)無 MAE 發(fā)生的患者比率在 ELUVIA 組和 Zilver PTX 組分別為 94.9%和 91%���,達到該臨床試驗的主要 安全性終點���。
此外,根據(jù)中心實驗室評價�,該試驗中研究器械組和對 照組技術(shù)成功率(定義為能夠通過并擴張靶病變,達到血管 造影下殘余狹窄程度不超過 30%)和手術(shù)成功率(定義為技術(shù) 成功并且在術(shù)后 24 小時內(nèi)無 MAE)均為 100%���。
24 個月時�,ELUVIA 組和 Zilver PTX 組的初始通暢率分 別為 74.7%和 72.1%,輔助初始通暢率分別為 88.5%和 91.1%�����, 兩組間均無統(tǒng)計學差異�。臨床癥狀驅(qū)動的 TLR 率在 ELUVIA 組和 Zilver PTX 組分別為 12.7%和 20.1%。支架 2 年長期隨 訪的結(jié)果支持其有效性和安全性�。
IMPERIAL 臨床試驗同時還包括了一項單組、非盲的針對 長病變(LL)的臨床試驗亞組研究���。研究供納入了 50 名植 入 ELUVIA 支架的患者,主要研究終點為術(shù)后 12 個月時的初 始血管通暢率��,以 Innova 長支架的既往數(shù)據(jù)作為目標值(60%) 而進行比較的臨床試驗結(jié)果顯示:12 個月時初始血管通暢率 為 86.4%��,高于 60%的目標值���,該試驗達到其設(shè)計有效性終 點��,且與 RCT 中 ELUVIA 組的安全性終點 12 個月無 MAE 發(fā)生率(94.9%)相似�,長病變患者臨床試驗亞組達到了 93.5% (43/46)的無 MAE 率��。
MAJESTIC 臨床試驗為一項前瞻性����、單臂�、多中心的臨床 研究���,在歐洲�����、澳大利亞和新西蘭的 14 個中心共入組了 57 例受試者�。主要有效性終點為由血管多普勒超聲(DUS)中 心實驗室判定的 9 個月初始血管通暢率�����;安全性終點為復(fù)合 主要不良事件�����,包括由臨床事件委員會裁定的術(shù)后 1 個月內(nèi) 的全死因死亡���、12 個月內(nèi)的靶肢體重癥截肢和靶病變血運重 建��。
9 個月時初始血管通暢率 94.4%�,主要不良事件發(fā)生率 為 3.6%。12 個月時復(fù)合主要不良事件發(fā)生率為 3.8%��;未出 現(xiàn)支架斷裂�����,無重大截肢事件的發(fā)生��,病人臨床癥狀明顯改 善�����,平均踝肱指數(shù)(ABI)從基線時 0.73±0.22 改善至 12 個 月時的 1.02±0.20��。
經(jīng) Kaplan–Meier 分析�����,24 個月時的初始血管通暢率為 83.5%����,且 90.6%的受試者仍保持臨床上的改善�����;36 個月時 免于靶病變血運重建的受試者達 85.3%,并且無支架斷裂和 重大截肢事件���。
提供了該產(chǎn)品 IMPERIAL 臨床研究日本人群亞組分析�, 以及臺灣����、新加坡的臨床數(shù)據(jù)分析等資料作為境內(nèi)外人群差 異對產(chǎn)品安全有效性無影響的證據(jù)。臨床證據(jù)支持產(chǎn)品受益大于風險����。
參照《YY/T0316-2016 醫(yī)療器械風險管理對醫(yī)療器械的 應(yīng)用》���,對該產(chǎn)品進行風險分析����。對目前已知及可預(yù)測風險 采取了風險控制措施���,經(jīng)綜合評價�����,在目前認知水平下�����,認 為該產(chǎn)品帶來的獲益/受益大于風險��。為保證用械安全�����,需 在說明書中提示以下信息:
(1)所提供的產(chǎn)品已采用環(huán)氧乙烷(EO)滅菌處理�����。如 無菌包裝破損��,請勿使用�。如發(fā)現(xiàn)破損,請致電 Boston Scientific Corporation 客服代表�����。
(2)僅限一次性使用�����。切勿重復(fù)使用����、重復(fù)加工或重 復(fù)滅菌。重復(fù)使用���、重復(fù)加工或重復(fù)滅菌可能會損壞產(chǎn)品的 結(jié)構(gòu)完整性和/或?qū)е庐a(chǎn)品故障����,從而使患者受傷����、患病或 死亡。重復(fù)使用�、重復(fù)加工或重復(fù)滅菌還可能造成產(chǎn)品污染 和/或引起患者感染或交叉感染(包括但不限于將傳染性疾病從一名患者傳染到另一名患者)。產(chǎn)品污染可能會導致患 者受傷�����、患病或死亡��。
(3)用完后����,請根據(jù)醫(yī)院、行政和/或當?shù)卣南嚓P(guān) 規(guī)定棄置該產(chǎn)品和包裝�。
(4)在使用之前��,請仔細閱讀全部說明�����。請遵守說明 中提到的所有警告和注意事項�����。否則可能導致患者出現(xiàn)并發(fā) 癥�。
(1)只有接受過相應(yīng)培訓且熟悉通常與股淺動脈和/或 腘動脈近端介入術(shù)相關(guān)的原理�����、臨床應(yīng)用�、并發(fā)癥、副作用 和危險的醫(yī)生方可使用本產(chǎn)品�。
(2)請勿在包裝上標明的失效日期后使用。使用前參 閱“包裝方式”部分����。
(3)跨越血管分叉或分支的支架置入可影響以后的診 斷或治療性操作。
(4)支架的設(shè)計不支持重新定位�����。
(5)支架部分置入后�����,不可使用支架輸送系統(tǒng)“重新收 攏”或“重新約束”�。
(6)與任何類型的血管內(nèi)植入物一樣,繼發(fā)于支架污 染的感染可能導致血栓�、假性動脈瘤或破裂進鄰近器官或腹 膜后腔。
(8)本產(chǎn)品不可用于有未經(jīng)治療的出血性疾病患者或 無法接受抗凝治療或抗血小板聚集治療的患者�����。
(9)已知對紫杉醇(或結(jié)構(gòu)類似的化合物)�����、聚合物或 其單獨成分(見以下部分的詳細信息:“引物共聚物和藥物基 質(zhì)共聚物載體”部分)����、鎳或鉭過敏的人群可能會對本植入物 產(chǎn)生過敏反應(yīng)。
(10)如果包裝袋標簽上的溫度接觸指示點變?yōu)榧t色則 請勿使用�����,這表明支架擴張性可能已受到破壞。
(11)如果包裝袋標簽上的溫度接觸指示點缺失�����,請勿 使用��。
(12)禁止暴露于有機溶劑(如乙醇)中�����。
該產(chǎn)品禁忌用于任何經(jīng)皮腔內(nèi)血管成形術(shù) (PTA) 的禁 忌情況���。
綜合評價意見
本申報產(chǎn)品屬于醫(yī)療器械優(yōu)先審批項目����,編號 20180032��。申請人的注冊資料符合現(xiàn)行要求���,依據(jù)《醫(yī)療器械監(jiān)督管理 條例》(國務(wù)院令第 680 號)���、《醫(yī)療器械注冊管理辦法》(國 家食品藥品監(jiān)督管理總局令 2014 年第 4 號)等相關(guān)醫(yī)療器 械法規(guī)與配套規(guī)章,經(jīng)系統(tǒng)評價后,建議準予注冊�����。



