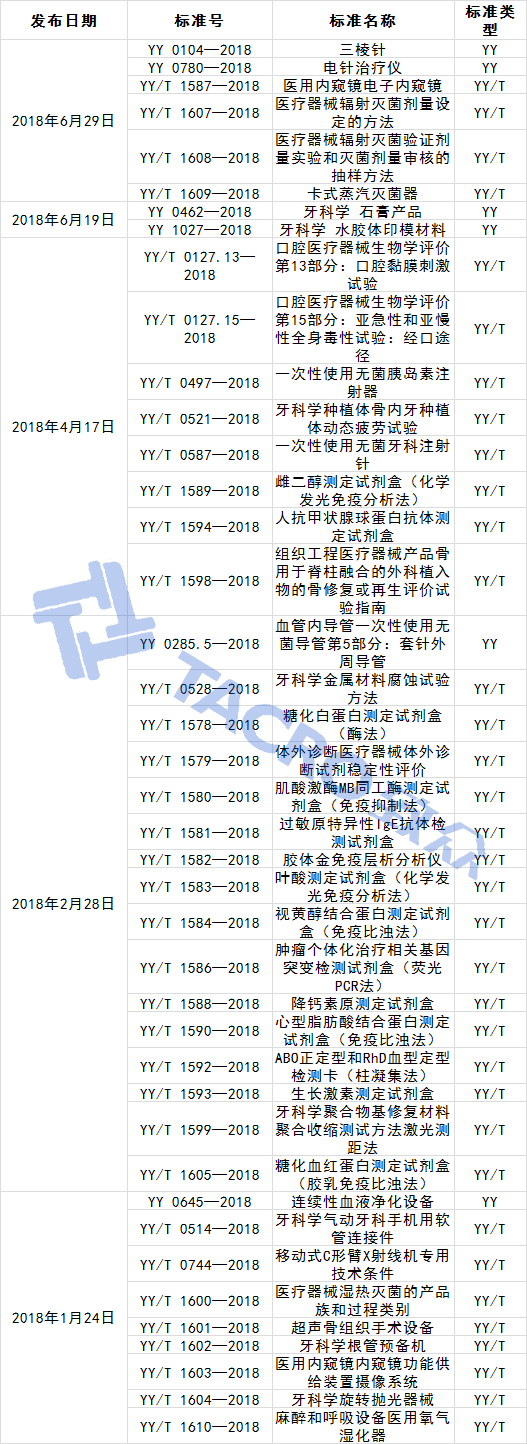
2018年新增標(biāo)準(zhǔn):
2018年新增技術(shù)指導(dǎo)原則:
|
序號 |
名稱 |
針對產(chǎn)品類別 |
發(fā)布日期 |
狀態(tài) |
查看地址 |
|
1 |
動物源性醫(yī)療器械注冊技術(shù)審查指導(dǎo)原則(2017年修訂版) |
|
2018年1月5日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/221700.html |
|
2 |
醫(yī)療器械臨床試驗設(shè)計指導(dǎo)原則 |
|
2018年1月8日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/221976.html |
|
3 |
質(zhì)子碳離子治療系統(tǒng)臨床評價技術(shù)審查指導(dǎo)原則 |
|
2018年1月8日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/221977.html |
|
4 |
全血及血液成分貯存袋等3項技術(shù)審查指導(dǎo)原則 |
無源 |
2018年1月10日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/222266.html |
|
5 |
接受醫(yī)療器械境外臨床試驗數(shù)據(jù)技術(shù)指導(dǎo)原則 |
|
2018年1月11日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/222385.html |
|
6 |
載脂蛋白A1測定試劑等3項注冊技術(shù)審查指導(dǎo)原則 |
IVD |
2018年1月16日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/222786.html |
|
7 |
發(fā)布丙氨酸氨基轉(zhuǎn)移酶測定試劑等5項注冊技術(shù)審查指導(dǎo)原則 |
IVD |
2018年1月16日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/222787.html |
|
8 |
X射線計算機(jī)體層攝影設(shè)備注冊技術(shù)審查指導(dǎo)原則 |
有源 |
2018年2月9日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/224560.html |
|
9 |
人表皮生長因子受體(EGFR)突變基因檢測試劑等4項注冊技術(shù)審查指導(dǎo)原則 |
IVD |
2018年2月24日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/225343.html |
|
10 |
超聲軟組織切割止血系統(tǒng)注冊技術(shù)審查指導(dǎo)原則 |
有源 |
2018年2月24日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/225344.html |
|
11 |
關(guān)于對《定制式增材制造醫(yī)療器械注冊技術(shù)審查指導(dǎo)原則》(征求意見稿)公開征求意見的通知 |
無源 |
2018年2月26日 |
已截止征求意見 |
http://www.cmde.org.cn/CL0063/6954.html |
|
12 |
眼科光學(xué)相干斷層掃描儀注冊技術(shù)審查指導(dǎo)原則 |
有源 |
2018年3月2日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/225719.html |
|
13 |
眼科飛秒激光治療機(jī)注冊技術(shù)審查指導(dǎo)原則 |
有源 |
2018年3月20日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/226709.html |
|
14 |
眼科超聲診斷設(shè)備注冊技術(shù)審查指導(dǎo)原則 |
有源 |
2018年3月20日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/226710.html |
|
15 |
結(jié)核分枝桿菌特異性細(xì)胞免疫反應(yīng)檢測試劑注冊技術(shù)審查指導(dǎo)原則 |
IVD |
2018年3月21日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/226784.html |
|
16 |
持續(xù)葡萄糖監(jiān)測系統(tǒng)注冊技術(shù)審查指導(dǎo)原則 |
有源 |
2018年3月21日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/226783.html |
|
17 |
硬性光學(xué)內(nèi)窺鏡(有創(chuàng)類)注冊技術(shù)審查指導(dǎo)原則 |
無源 |
2018年3月27日 |
實施中 |
http://samr.cfda.gov.cn/WS01/CL2039/227087.html |
|
18 |
口腔曲面體層X射線機(jī)注冊技術(shù)審查指導(dǎo)原則 |
有源 |
2018年4月16日 |
實施中 |
http://cnda.cfda.gov.cn/WS04/CL2050/227776.html |
|
19 |
氣腹機(jī)等4項注冊技術(shù)審查指導(dǎo)原則 |
有源 |
2018年4月20日 |
實施中 |
http://cnda.cfda.gov.cn/WS04/CL2050/227814.html |
|
20 |
軟性接觸鏡和人類體外輔助生殖技術(shù)用液等2項注冊技術(shù)審查指導(dǎo)原則 |
無源 |
2018年4月26日 |
實施中 |
http://cnda.cfda.gov.cn/WS04/CL2050/227857.html |
|
21 |
手術(shù)顯微鏡等4項注冊技術(shù)審查指導(dǎo)原則 |
無源 |
2018年5月18日 |
實施中 |
http://cnda.cfda.gov.cn/WS04/CL2050/228073.html |
|
22 |
麻醉咽喉鏡等3項注冊技術(shù)審查指導(dǎo)原則 |
無源 |
2018年5月31日 |
實施中 |
http://cnda.cfda.gov.cn/WS04/CL2050/228228.html |
|
23 |
關(guān)于征求《用于角膜制瓣的眼科飛秒激光治療機(jī)臨床試驗指導(dǎo)原則(征求意見稿)》意見的通知 |
有源 |
2018年6月19日 |
征求意見中(2018/7/20截止) |
http://www.cmde.org.cn/CL0004/7611.html |
|
24 |
關(guān)于征求《一次性使用活檢針注冊技術(shù)審查指導(dǎo)原則(征求意見稿)》意見的通知 |
無源 |
2018年6月20日 |
征求意見中(2018/7/21截止) |
http://www.cmde.org.cn/CL0004/7622.html |
|
25 |
角膜塑形用硬性透氣接觸鏡及軟性接觸鏡2項臨床試驗指導(dǎo)原則 |
無源 |
2018年7月5日 |
實施中 |
http://cnda.cfda.gov.cn/WS04/CL2050/229671.html |